医疗器械全生命周期所涉及的GXP体系,不仅涵盖我们熟知的GMP,还囊括其他多项重要法规。那么,具体来说,医疗器械全流程会受到哪些GXP体系的规范呢?这些理念源于制药行业,我们首先来一探究竟药品相关法规之间的内在联系。
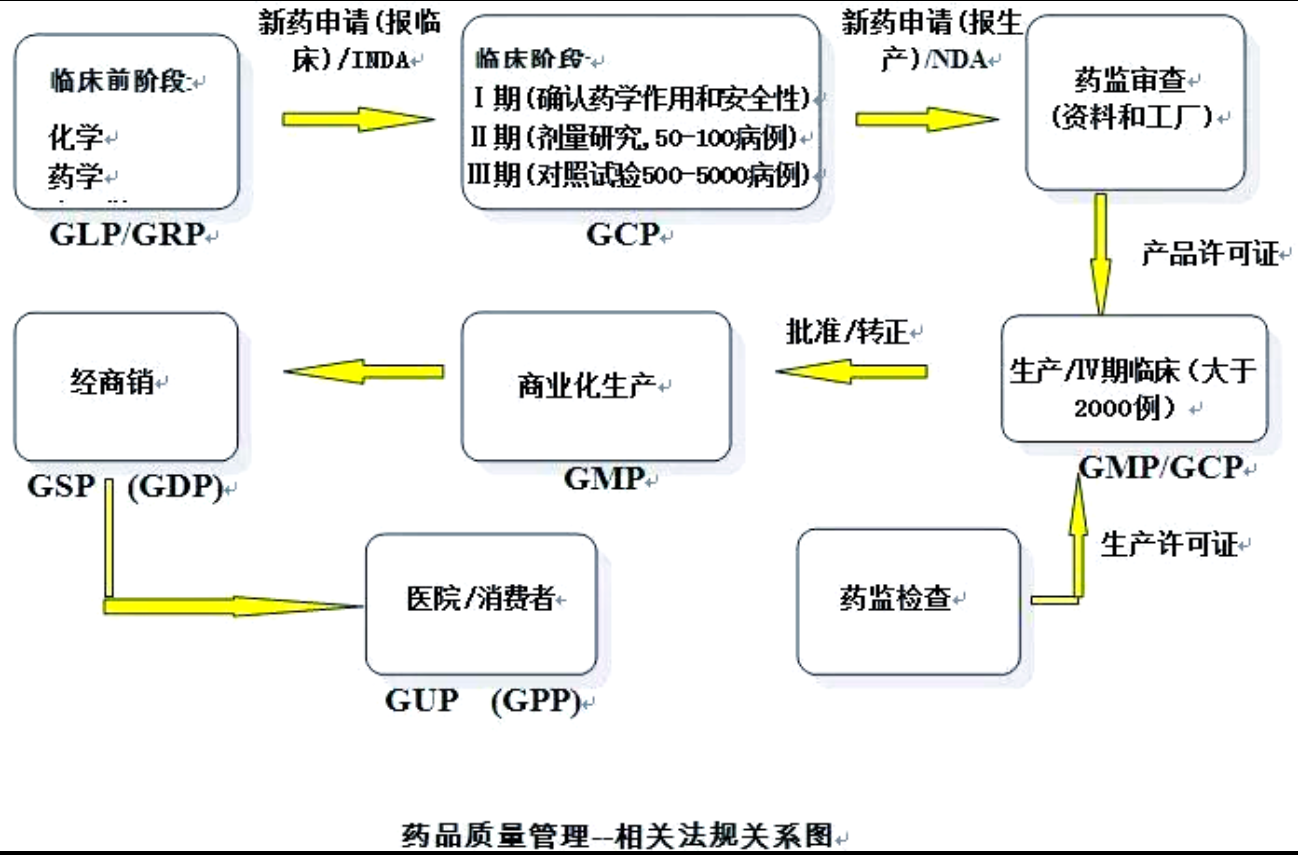
制药行业GXP的内涵解析
G,代表Good,意为优良、出色,强调标准与质量。
X,与数学中的X、Y、Z中的X相仿,象征着广泛、不确定,涵盖各类情况。
P,即Practice,意为实践、惯例,强调执行与操作。
接下来,我们将对制药行业中常见且重要的法规进行概述与汇总。
GLP(优良实验室规范)是药品非临床研究的质量管理标准。
GCP(药品临床研究质量管理规范)确保药品临床研究的质量与可靠性。
GMP(药品生产质量管理规范)涵盖了药品生产过程中的质量控制要点。
GSP(药品经营质量管理规范)则规定了药品在流通环节的质量管理要求,有时在美国也被称为GDP(良好分销规范)。
GAP(中药材生产质量管理规范)确保中药材从种植到采收的全过程质量。
GRP(药品研究质量管理规范)规范药品研究的每一个环节,保障研究质量。
GUP(药品使用质量管理规范及医疗机构制剂质量管理规范)则关注药品在医疗机构中的使用及制剂的质量。
此外,还有Good Hospital Preparation Practice(GPP),强调医疗机构制剂的规范制备。在中国,这一规范通常被称为GUP。
另外,技术行业也涉及到类似的GXP规范,如:
GVP(验证管理规范)确保药品生产过程中的验证工作得到妥善执行。
GEP(药品提取操作规范)规范药品提取过程,确保提取操作的正确性和安全性。
同时,技术行业还涉及其他GXP规范,如药品工程技术类管理规范(Good Engineering Practice),专注于药品生产过程中的工程技术问题。
- GDP(良好申报资料质量体系)
近年来,医疗器械的管理逐渐借鉴了制药行业的一些标准。目前,GMP和GSP已成为医疗器械生产和流通的规范要求。此外,GXP体系也正在不断完善,涵盖了从实验室、临床试验到生产、经营、使用的全方位质量管理。
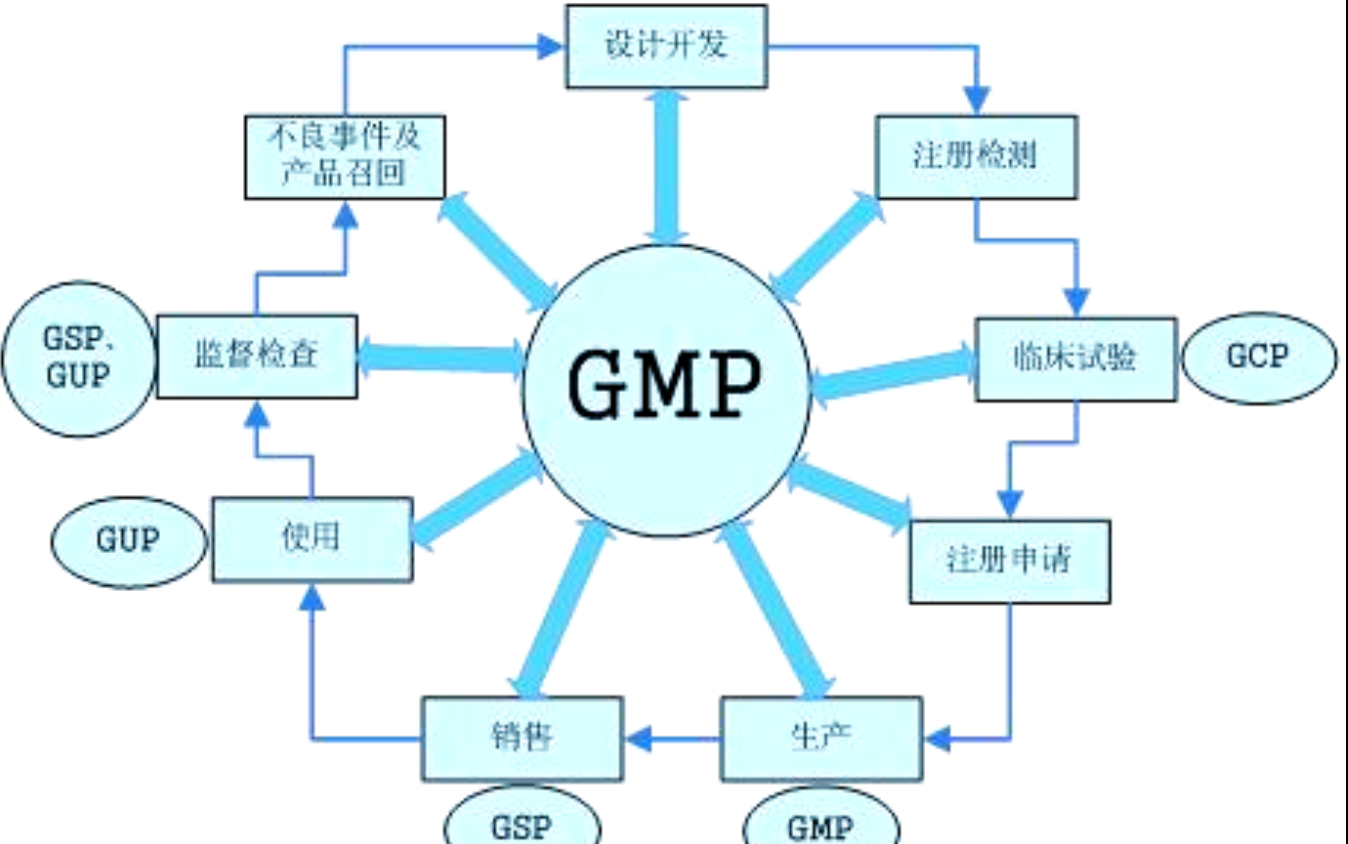
GXP体系实施时间表
体系名称:GCP(医疗器械临床试验质量管理规范)
执行时间:目前正处于征求意见阶段。
此外,还有医疗器械临床评价技术指导原则,该原则与GCP体系密切相关,共同构成了医疗器械临床试验质量管理的全方位规范。
2014年9月11日,体外诊断试剂临床试验技术指导原则发布。随后,在2015年5月19日,GMP医疗器械生产质量管理规范也正式亮相。而自2015年3月1日起,这些规范便开始逐步实施。
自2016年1月1日起,所有第三类医疗器械必须符合相关标准。
2018年1月1日以后,所有医疗器械及体外诊断试剂生产企业必须遵循《医疗器械生产质量管理规范》附录中的无菌医疗器械和植入性医疗器械的相关规定。
2015年10月1日,医疗器械生产质量管理规范附录体外诊断试剂正式实施。同时,为确保医疗器械及体外诊断试剂的质量与安全,2015年9月25日,医疗器械生产质量管理规范无菌医疗器械现场检查指导原则也同步发布。这些标准的实施,为医疗器械行业的规范化发展奠定了坚实基础。
2015年9月25日,为进一步规范医疗器械生产质量管理,确保植入性医疗器械的安全与有效,医疗器械生产质量管理规范的相关现场检查指导原则也同步问世。这一举措,无疑为医疗器械行业的持续健康发展提供了更为全面的保障。
2015年9月25日,为进一步强化医疗器械生产质量监管,保障体外诊断试剂的安全与效能,医疗器械生产质量管理规范中针对体外诊断试剂的现场检查指导原则也得以颁布。这一重要文件的出台,标志着医疗器械行业监管体系又迈上了新的台阶。
2015年9月25日,医疗器械行业的另一项重要法规也得以颁布,即《医疗器械经营质量管理规范》。此外,为了加强医疗器械生产质量监管,保障体外诊断试剂的安全与效能,专门针对体外诊断试剂的现场检查指导原则也得以出台。这一系列的法规修订与完善,无疑将进一步提升医疗器械行业的监管水平。
在医疗器械监管方面,我们还需要关注其他相关法规的实施。例如,GSP医疗器械使用质量监督管理办法自2016年2月1日起实施,标志着医疗器械使用环节的质量监管也得到了加强。同时,GXP体系监管方式也成为了医疗器械行业的重要监管手段。
在执行GXP体系的过程中,我们需要明确监管主体和监管对象。对于不同环节的医疗器械质量监管,药监局、临床试验机构、生产企业以及经营企业等都有明确的职责和要求。此外,GCP和GMP的现场核查、监督检查以及自查也是确保医疗器械质量的重要措施。
对于想要申请GCP资质的医疗机构,需要满足一定的条件。例如,取得《医疗机构执业许可证》并具备二级甲等以上资质的医疗机构,可以按照《医疗器械临床试验机构资质认定管理办法(征求意见)》的要求进行申请。而GMP的执行则需严格遵循《医疗器械生产质量管理规范现场检查指导原则》中的各项规定。
若某项不符合标准被标记为“”①,则该产品将“未通过检查”;
若不符合项仅为非“”②项,但该不符情况可能对产品质量产生直接影响,那么该产品同样“未通过检查”;
若不符合项仅为非“*”项,且该不符情况不会直接影响到产品质量,那么该产品将进入“整改后复查”流程。
此外,GSP医疗器械使用质量监督管理办法也提出了具体要求,根据《医疗器械经营质量管理规范现场检查指导原则》中的相关条款,进一步规范了医疗器械的经营行为。
若某项不符合标准被标记为“※”①,则该产品将直接“未通过检查”;
若不符合项仅为非“※”项,但该不符情况对产品质量构成重大影响,即不符合要求的项目数比例③超过10%,那么该产品同样被判定为“未通过检查”;
若不符合项仅为非“※”项,且该不符情况不会对产品质量产生直接影响,同时不符合要求的项目数比例③不超过10%,那么该产品将获得“限期整改”的机会。
此外,GUP医疗器械使用质量监督管理办法也提出了详细的规定,涵盖了采购、验收、贮存、使用、维护以及转让等各个环节的具体要求。
①“”项或“※”项被定义为关键项目;
②而非“”项或非“※”项则被归类为一般项目。
③(此处可接续关于项目比例的具体描述或相关分析)



评论一下吧
取消回复